Terapia funkcji poznawczych w chorobie Alzheimera
listopad 13, 2009 by Jarek
Kategoria: Mózg, układ nerwowy
Tomasz Sobów
Źródło: Sekcja Psychogeriatrii i Choroby Alzheimera Polskiego Towarzystwa Psychiatrycznego
Zasady ogólne
Zanim zaordynuje się leki działające objawowo, należy u każdego pacjenta dokonać weryfikacji stopnia nasilenia otępienia, wykorzystując standardowe narzędzia psychometryczne (w praktyce lekarza rodzinnego może to być test MMSE). Powyższa, wyjściowa ocena jest niezbędna jako punkt referencyjny dla późniejszej ewaluacji efektów terapii. Przed włączeniem leczenia objawowego należy również stwierdzić, czy obserwowane zaburzenia nie są związane z innymi, niezależnymi od choroby Alzheimera, czynnikami, takimi jak: stosowanie leków o działaniu antycholinergicznym, obecność niestabilnej choroby somatycznej lub towarzyszących zaburzeń psychicznych (zwłaszcza depresji i zaburzeń lękowych).
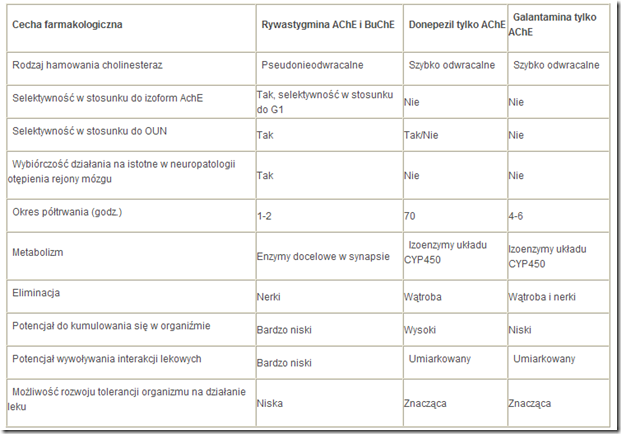
Tabela 16. Zróżnicowany profil farmakologiczny inhibitorów cholinoesterazy
Obecny stan wiedzy na temat stosowania leków wpływających na zaburzenia funkcji poznawczych w AD wskazuje na konieczność długoterminowej i nieprzerywanej farmakoterapii oraz na celowość podejmowania w miarę możliwości wczesnej interwencji zarówno farmakologicznej, jak i niefarmakologicznej. Wyniki prób klinicznych wskazują, że u pacjentów, u których podejmuje się leczenie później (wielu klinicystów "oczekuje" na "wyraźne" objawy choroby zanim włączy leki), wyniki są gorsze niż u tych, u których terapię rozpoczyna się wcześniej. Zaobserwowano ponadto, że błędem jest przerywanie leczenia (badania kliniczne dotyczą inhibitorów cholinesterazy) i ponowne jego wdrażanie po kilkudniowej przerwie; chorzy, u których stosowano takie "wakacje", wypadali w obserwacjach klinicznych gorzej od tych, u których leczenie stosowano w sposób ciągły. Nie istnieją jednoznaczne zalecenia co do podjęcia decyzji o odstawieniu stosowanych leków. Rekomendowane przez niektóre grupy eksperckie (np. brytyjską NICE) wyniki testu MMSE, poniżej których nie zaleca się stosowania inhibitorów cholinesterazy, mają charakter arbitralny i nie znajdują umocowania w żadnych badaniach klinicznych. Racjonalnym wydaje się być zalecanie indywidualnej i kompleksowej oceny skuteczności leczenia i kontynuowanie go tak długo, jak długo w ocenie klinicysty i/lub pacjenta oraz – zwłaszcza – opiekuna widoczne są korzystne efekty stosowanych leków.
Farmakoterapia zaburzeń funkcji poznawczych w AD
Neurochemiczne podłoże choroby Alzheimera jest badane systematycznie od początku lat siedemdziesiątych ubiegłego stulecia. Najlepiej udokumentowany jest deficyt przekaźnictwa cholinergicznego i oparta o jego analizę hipoteza cholinergiczna AD. Istnieją również dowody na zaburzenia przekaźnictwa glutaminianergicznego.Woparciu o powyższe obserwacje neurochemiczne i ich korelaty kliniczne opracowano dostępne dziś w kliniczne metody farmakoterapii zaburzeń funkcji poznawczych AD. Pierwszym wprowadzonym do leczenia skutecznym lekiem o działaniu cholinomimetycznym był inhibitor cholinesterazy, takryna (Cognex®); lek ten wycofano z lecznictwa ze względu na hepatotoksyczność. Obecnie stosuje się trzy inhibitory cholinesterazy, wszystkie są dostępne w Polsce: donepezil (Aricept®, Donepex®, Yasnal®, Cogiton®), rywastygmina (Exelon®) i galantamina (Reminyl®); podstawowe właściwości i schematy dawkowania zestawiono w tabeli 17. Badania oceniające skuteczność wszystkich inhibitorów przynoszą podobne wyniki i wskazują na umiarkowany efekt objawowy (różnica w porównaniu z placebo rzędu 3-5 punktów w standardowej skali ADAS-cog), poprawę aktywności dnia codziennego oraz wpływ na niektóre zaburzenia psychiczne towarzyszące otępieniu, takie jak omamy, urojenia, apatia, pobudzenie czy bezcelowa nadaktywność (Rogers i wsp., 1198; Rosler i wsp., 1999; Wilcock i wsp., 2000).
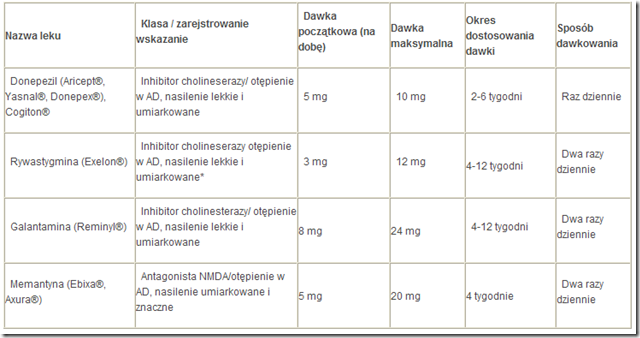
Tabela 17. Leki zalecane w leczeniu otępienia w chorobie Alzheimera
Odrębności poszczególnych inhibitorów obejmują (patrz tab. 16):
-
powinowactwo do dwóch podstawowych typów cholinesteraz (donepezil – działający wyłącznie na syntetyzowaną w neuronach acetylocholinesterazę [AChE] i o nikłym efekcie na syntetyzowaną w komórkach glejowych oraz występującą w krwi krążącej butyrylocholinesterazę [BuChE], rywastygmina bedącą inhibitorem obu uczestniczących w rozkładzie acetylocholiny mózgowej enzymów),
-
okres półtrwania (najdłuższy w przypadku donepezilu, co pozwala na dawkowanie raz na dobę),
-
selektywność do izoform cholinesteraz (powinowactwo wyłącznie do izoformy G1 – rywastygmina oraz do izoform G2 i G4 – donepezil, galantamina),
-
farmakokinetyczny rodzaj inhibicji (szybko odwracalny donepezil i galantamina i pseudonieodwracalny – rywastygmina)
-
allosteryczny efekt modulacyjny na receptory nikotynowe (dotyczy to zwłaszcza galantaminy, w mniejszym stopniu donepezilu).
Profil objawów niepożądanych wszystkich inhibitorów jest zbliżony i obejmuje przede wszystkim następstwa obwodowej stymulacji przekaźnictwa cholinergicznego, takie jak nudności, wymioty, biegunki, spadek łaknienia, skurcze mięśni, łzawienie, surowiczy wyciek z nosa, a także mniej specyficzne objawy, takie jak bóle głowy czy uczucie ogólnego osłabienia.
Zasadą leczenia inhibitorami cholinestarazy jest podawanie maksymalnej dobrze tolerowanej dawki dobowej, którą należy indywidualnie dostosowywać do każdego pacjenta.Wprzypadku wszystkich badań klinicznych z wykorzystaniem inhibitorów cholinesterazy stosowano podobny sposób dawkowania, mianowicie podawano najniższą dawkę przez ograniczoną liczbę tygodni badania (zwykle 4) i następnie podejmowano próbę jej podwyższenia.Wprzypadku donepezilu obie dostępne komercyjnie dawki (5 i 10mg) zostały ocenione jako klinicznie skutecznie, podczas gdy w przypadku rywastygminy i galantaminy dawki początkowe (odpowiednio 3 i 8 mg na dobę) są prawdopodobnie nieskuteczne u większości pacjentów. Warto zwrócić uwagę, że w żadnym badaniu klinicznym nie oceniono celowości sposobu dawkowania polegającego na podawaniu najniższej dostępnej dawki i, w razie zauważalnego klinicznie efektu, długotrwałym jej stosowaniu. Ze względu na brak odpowiednich badań nie można zalecać takiego postępowania.
Z badań wynika ponadto, że istnieją przesłanki kliniczne wyboru inhibitora cholinesterazy. Chorzy z szybką progresją objawów otępienia, objawam psychotycznymi, zaburzeniami snu i pobudzeniem oraz towarzyszącymi objawami parkinsonowskimi prawdopodobnie najlepiej zareagują na leczenie rywastygminą (Rosler i wsp., 1999, Farlow i wsp., 2001), chorzy z dominującą apatią, objawami depresyjnymi i lękowymi prawdopodobnie najlepiej zareagują na leczenie donepezilem (Rogers i wsp., 1998), zaś pacjenci z patologią mieszaną (alzheimerowską i naczyniową) – na leczenie galantaminą (Erkinjuntti i wsp., 2002).
Istnieje niewiele badań na temat stosowania innego inhibitora, gdy jeden z nich jest uprzednio nieskuteczny, a także badań porównujących inhibitory bezpośrednio między sobą; racjonalna wydaje się zawsze i bywa klinicznie skuteczna próba zmiany w przypadku braku efektu lub nietolerancji pierwotnie wybranego leku. Zdecydowanie nie należy zalecać łączenia inhibitorów ze sobą u jednego pacjenta! Jedyne poprawne metodologicznie badanie, w którym porównywano dwa inhibitory cholinesterazy w aktualnie zalecanych dawkach i schematach ich stosowania opublikowano w 2005 roku (EXCEED; Bullock i wsp., 2005). W badaniu tym wykazano, że w zalecanych dawkach i przy powolnym schemacie podnoszenia dawek zarówno donepezil, jak i rywastygmina pokazały się być porównywalne pod względem skuteczności, jak i tolerancji leczenia.Wsubanalizie wyników tego badania wykazano, że rywastygmina jest lepszym wyborem dla chorych poniżej 75. roku życia, podczas gdy u starszych pacjentów oba leki nie różniły się skutecznością (Bullock i wsp., 2006). Wynika z niej także, że szczególnie dobrymi kandydatami do leczenia rywastygminą mogą być chorzy, których objawy kliniczne (halucynacje, parkinsonizm) sugerują współistnienie patologii typu korowych ciał Lewy’ego oraz chorzy z tzw. dzikim (ang. wild type - wt) geotypem butyrylocholinesterazy ( BuChE wt/wt) (Bullock i wsp., 2006).
Inhibitory cholinesterazy posiadają rejestrację do leczenia lekko i umiarkowanie nasilonego otępienia w chorobie Alzheimera. Warto podkreślić, że ocena stopnia nasilenia otępienia nie powinna polegać wyłącznie na badaniu psychometrycznym, lecz brać także pod uwagę funkcjonowanie pacjenta oraz indywidualne cechy demograficzne, takie jak wiek, płeć i wykształcenie chorych.
Pojedyncze badania sugerują skuteczność donepezilu i rywastygminy także u chorych ze znacznym nasileniem objawów, ale wymaga to jeszcze dalszych badań na większych grupach chorych (Feldman i wsp., 2001; Doraiswamy i wsp., 2002). Przerwanie terapii inhibitorem cholinesterazy powinno być zatem zawsze poprzedzone dokładną oceną efektów leczenia i nie może opierać się wyłącznie na wynikach testów psychometrycznych, sugerujących przejście chorego w znacznie nasilone otępienie.
U chorych z umiarkowanym i znacznym nasileniem otępienia rejestrację do leczenia zaburzeń funkcji poznawczychwchorobieAlzheimera posiada memantyna, niekompetycyjny antagonista NMDA. W dwóch badaniach klinicznych (Winblad i wsp., 1999) wykazano na grupie ponad 400 chorych skutecznośćmemantyny (w dawkach 10-20 mg/dobę) w zakresie codziennego funkcjonowania chorych, a także w niektórych aspektach funkcji poznawczych, nawet u chorych ze znacznie zaawansowanym otępieniem (MMSE < 10). W randomizowanym badaniu klinicznym wykazano ponadto, że terapia łączona (inhibitor cholinesterazy + memantyna) przewyższa leczenie samym inhibitorem w przypadku pacjentów z umiarkowanie i znacznie nasilonym otępieniem (MMSE 5-14) (Tariot i wsp., 1999).
Zalecane leki w farmakoterapii zaburzeń funkcji poznawczych w chorobie Alzheimera zestawiono w tabeli 17.
Inne leki w objawowej farmakoterapii AD
Spośród innych leków proponowanych do leczenia otępienia w chorobie Alzheimera na uwagę zasługują selegilina (Jumex®, Selerin®, Segan®), witamina E oraz preparaty zawierące ekstrakt z Ginkgo biloba (Ginkofar®, Bilobil®, Tanakan®). Selegilina (w dawce 10mg/dobę) i witamina E (w bardzo wysokiej dawce 2000 IU/dobę) były oceniane w jednym dużym badaniu randomizowanym trwającym 2 lata (Sano i wsp., 1997), w którym nie wykazano wprawdzie efektu objawowego, ale którego wyniki zdają się wskazywać na możliwy efekt modyfikujący przebieg choroby (obserwowano opóźnienie wystąpienia niektórych zdarzeń w naturalnym przebiegu otępienia, takich jak konieczność zapewnienia stałej opieki, umieszczenie w placówce opiekuńczej czy śmierć chorych). Dane dotyczące skuteczności ekstraktów Ginkgo biloba (EGb 761) na objawy deficytu poznawczego w otępieniu w chorobie Alzheimera są sprzeczne. Nie istnieją żadne dowody na skuteczność innych leków,w tym często zalecanych preparatów piracetamu oraz leków wpływających na sprawność krążenia mózgowego.
Farmakologiczne metody wpływu na progresję choroby Alzheimera
Nie opublikowano dotąd wyników badań, które w sposób jednoznaczny wskazywałyby na możliwość farmakologicznego oddziaływania na progresję podstawowego procesu patologicznego w AD. Sugestie wynikające z badań epidemiologicznych, wskazujące na możliwość takiego wpływu przez leki przeciwzapalne, estrogeny czy witaminę E nie zostały potwierdzone, a wyniki niektórych badań wskazują wręcz na potencjalne niekorzystne działanie tych leków (Aisen i wsp., 2003).
W przypadku towarzyszących chorób układu krążenia obowiązują te same zasady prewencji wtórnej jak w przypadku udaru lub zawału mięśnia sercowego. Dane z badań klinicznych dotyczące ewentualnych korzyści ze stosowania statyn, leków przeciwpłytkowych czy hipotensyjnych są niekompletne i uniemożliwiają na obecnym etapie wiedzy sformułowanie szczegółowych rekomendacji co do wyboru konkretnych leków.
Rekomendacje:
-
W przypadku rozpoznania otępienia o lekkim i umiarkowanym nasileniu w AD zaleca się zastosowanie inhibitora cholinesteraz.
-
Wprzypadku braku skuteczności jednego inhibitora cholinesterazy warto podjąć próbę leczenia innym lekiem z tej grupy.
-
Wprzypadku otępienia o umiarkowanym do znacznego i znacznym nasileniu w AD zaleca się zastosowanie memantyny.
-
Terapia kombinowana (inhibitor cholinesterazy i memantyna) może być rozważona jako opcja terapeutyczna.
-
Stosowanie innych leków niż inhibitory cholinesterazy i memantynaw celu poprawy istniejących zaburzeń funkcji poznawczych nie znajduje uzasadnienia w badaniach klinicznych i nie jest rekomendowane
Piśmiennictwo:
-
Aisen P.S., Schafer K.A., Grundman M., Pfeiffer E., Sano M., Davis K.L., Farlow M.R., Jin S., Thomas R.G., Thal L.J.: Alzheimer’s Disease Cooperative Study. Effects of rofecoxib or naproxen vs placebo on Alzheimer disease progression: a randomized controlled trial. JAMA 2003 Jun 4; 289(21): 2819-26.
-
Bullock R.A., Bergman H., Touchon J., Gambina G., He Y., Nagel J., Lane R.: Effect of age on response to rivastigmine or donepezil in patients with Alzheimer’s disease. Curr Med Res Opin 2006; 483-494.
-
Bullock R.A., Touchon J., Bergman H. i wsp.: Rivastigmine and donepezil treatment in moderate to moderately severe Alzheimer’s disease over 2 years. Curr Med Res Opin 2005; 21: 1317-27.
-
Doraiswamy P.M., Krishnan K.R., Anand R., Sohn H., Danyluk J., Hartman R.D., Veach J.: Long-term effects of rivastigmine in moderately severe Alzheimer’s di- sease: does early initiation of therapy offer sustained benefits? Prog Neuropsychopharmacol Biol Psychiatry 2002 May; 26(4): 705-12.
-
Erkinjuntti T., Kurz A., Gauthier S., Bullock R., Lilienfeld S., Damaraju C.V.: Efficacy of galantamine in probable vascular dementia and Alzheimer’s disease combined with cerebrovascular disease: a randomised trial. Lancet. 2002 Apr 13; 359(9314):1283-90.
-
Farlow M.R., Hake A., Messina J., Hartman R., Veach J., Anand R.: Response of patients with Alzheimer disease to rivastigmine treatment is predicted by the rate of disease progression. Arch Neurol 2001 Mar; 58(3): 417-22.
-
Feldman H., Gauthier S., Hecker J.:A24 week randomized double blind study of donepezil in moderate to severe Alzheimer’s disease. Neurology 2001, 57, 613-620.
-
Inglis F.: The tolerability and safety of cholinesterase inhibitors in the treatment of dementia. International Journal of Clinical Practice, 2002, 127, 45-63.
-
Reisberg B., Doody R., Stöffler A., Schmitt F., Ferris S., Möbius H.J.: Memantine in moderate-to-severe Alzheimer’s disease. N Engl J Med 2003, 348, 1333-1341.
-
Rogers S.L., Farlow M.R., Doody R.S.: A 24 week, double-blind, placebo controlled trial of donepezil in patients with Alzheimer’s disease. Neurology 1998, 50, 136-145.
-
Rosler M, Anand R, Cicin-Sain A: Efficacy and safety of rivastigmine in patients with Alzheimer’s disease. Br Med J 1999, 318, 633-8
-
Sano M., Ernesto C., Thomas R.G.: A controlled trial of selegiline, alpha tocopherol or both as treatment for Alzheimer’s disease. N Engl J Med 1997, 336, 1216-22.
-
Shumaker S.A., Legault C., Rapp S.R., Thal L., Wallace R.B., Ockene J.K., Hendrix S.L., Jones B.N. 3rd, Assaf A.R., Jackson R.D., Kotchen J.M., Wassertheil-Smoller S., Wactawski-Wende J.: WHIMS Investigators. Estrogen plus progestin and the incidence of dementia and mild cognitive impairment in postmenopausal women: the Women’s Health Initiative Memory Study: a randomized controlled trial. JAMA 2003 May 28; 289(20): 2651-62.
-
Tariot P.N., Farlow M.R., Grossberg G.T., Graham S.M., McDonald S., Gergel I.: Memantine Study Group. Memantine treatment in patients with moderate to severe Alzheimer disease already receiving donepezil: a randomized controlled trial. JAMA 2004 Jan 21; 291(3):317-24.
-
Wilcock G.K., Lilienfeld S., Gaens E.: Efficacy and safety of galantamine in patients with mild to moderate Alzheimer’s disease. Br Med J 2000, 321, 1445-1449.
-
Winblad B., Poritis N.: Memantine in severe dementia: results of the M-best study.nt J Geriatr Psychiatry 1999, 14, 135-146.