MAT 1 i wysoka homocysteina.
sierpień 21, 2017 by Jarek
Kategoria: MTHFR i inne polimorfizmy
Już kiedyś pisałem na temat polimorfizmów genu MAT1, MAT2 często określanych jako geny BOGÓW…bo są na końcu całej metylacji i mogą zepsuć cały nasz wysiłek zmierzający do naprawy metylacji na poziomie genów MTHFR, MTRR, CBS, BHMT. One są na końcu po prostu, a ostatnie moje artykuły na ten temat zwiększyły Wasze zainteresowanie tym tematem…więc wracam do tych genów.
http://www.zespoldowna.info/cacna1c-gabra6-gabra2-mat1-a-mat2bil-6-il-1.html
http://www.zespoldowna.info/metionina-i-wysoka-homocysteina-w-ciazy.html
http://www.zespoldowna.info/wysoka-homocysteina-to-zagrozenie-dla-ciazy.html
http://www.zespoldowna.info/prekursor-nad-dla-zespolu-downa-autyzmu-i-dobrej-ciazy.html
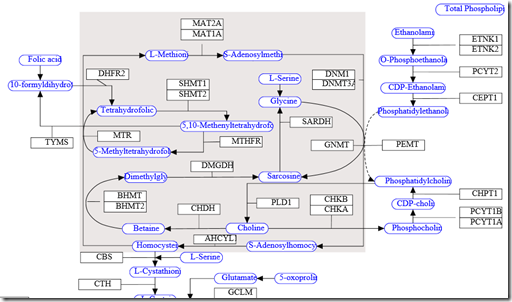
Popatrzmy na ten wykres z wikipathway.com
Oba geny znajdują się w miejscu, gdy mamy przygotowaną już l-metioninę w wyniku remetylacji homocysteiny i geny MAT przy udziale magnezu dołączają do niej grupę adenosylową z ATP, tworząc S-adenozylometioninę podstawowy produkt metylacji. Wyobraźmy sobie teraz taką sytuację:
1.Wszystkie cykle: cysteiny, kwasu foliowego, kobalaminy, skrót metylacyjny działają bez żadnych polimorfizmów. Działamy wtedy świetnie, jako ludzie i kto wie czy nie stajemy się długowieczni.
2.Nagle w tych cyklach (w szczególności w cyklu metioniny) następuje “dziura” np. brak genu MAT1. Cała praca pozostałych cyklów, genów idzie na marne, metylacja jest załamana. Jeżeli popatrzymy na tą sytuację ciut bardziej optymistycznie i wiemy, że w pewnej części ścieżki “mamy dużo małych dziur” to wiemy, że możemy przejść przez nią ale wiemy, że w każdym momencie może brakować odpowiedniego przejścia.
3.MAT1/MAT2 budują ostateczne “przejście” dla efektów pracy wszystkich wcześniejszych cykli. Jeżeli mają polimorfizmy, to mają “dziury”, które powodują dużą nieefektywność pracy wszystkich cykli.
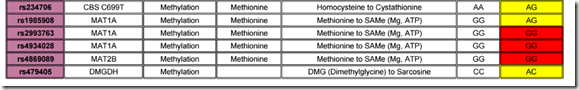
Ostatnio widziałem panele metylacyjne osób z bardzo wysoką homocysteiną, które nie miały lub miały mało znaczące polimorfizmy na cyklach kwasu foliowego, kobalaminy, cysteiny i skrótu metylacyjnego. Jednak wysoka homocysteina była efektem polimorfizmów genów MAT1/MAT2 tak jak tutaj poniżej.
https://www.ncbi.nlm.nih.gov/gene/4143
Podkreślam, że na genach typowych dla wysokiej homocysteiny te osoby nie miały polimorfizmów bo zarówno MTHFR C677T, MTRR A66 G, MTR A2756 G, BHMT G 742 A były wolne od tego typu zmian. To mnie na tyle zaintrygowało, że szukałem przyczyn tego problemu, a priori odrzucając polimorfizmy CBS, gdyż tak to wychodziło z panelu metylacyjnego. Zająłem się MAT-ami.
https://www.ncbi.nlm.nih.gov/pubmed/12145770
Polimorfizm ten jest znany od blisko 20 lat. Już wtedy wskazywano na konieczność badania poziomu cysteiny, metioniny i sakrozyny by jednoznacznie definiować problem i jego początki, gdyż efekty deficytów MAT są bardzo podobne do tego co dają polimorfizmy CBS.
W sytuacji, gdy mamy wysoki poziom homocysteiny i badania polimorfizmów genów: MAT 1 i MAT2, konieczne staje się zatem zdiagnozowanie poziomu metioniny. Jeżeli poziom metioniny jest wysoki to staje się to potwierdzenie deficytów w funkcjonowaniu obu genów.
https://www.ncbi.nlm.nih.gov/pubmed/23973726
https://www.ncbi.nlm.nih.gov/pubmed/23993429
Przed jakim stoimy zatem zagrożeniem? Patrząc na ten raport to przede wszystkim przed problemami neurologicznymi, od których możemy uciec eliminując z naszej diety metioninę. Drugi problem to wysoka homocysteina i jej niszczący wpływ na nasz układ krwionośny, serce i mózg. Te polimorfizmy mogą być istotnym zagrożeniem, pomimo tego że czujemy się przez lata dobrze.
Przyjęto określać polimorfizm genów MAT jako Mudd’s diease, chorobą charakteryzującą się wysokim poziome metioniny i homocysteiny, uszkadzający układ nerwowy.
https://ojrd.biomedcentral.com/articles/10.1186/s13023-015-0321-y
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4545930/
http://www.sciencedirect.com/science/article/pii/S2214426917300630
Jakie są najważniejsze wnioski dla nas w tym kontekście:
1.Wysoka metionina tytułem błędów na tym genie jest dziedziczna, zatem należy obserwować co się dzieje w rodzinie i jakie są skutki chorobowe. Najczęstsze przypadki to MAT1 R264H w układzie heterozygotycznym!
MAT1A mutations are turning out to be the most common genetic cause of newborn hypermethioninemia [28–31]. Most such cases are heterozygous for R264H
2.Poziom metioniny, któremu towarzyszą problemy w układzie nerwowym to poziom powyżej 800 μM
Those with mean values above 800 μM almost always have CNS abnormalities, whereas those with means less than 800 μM usually do not.
3.Gdy poziom metioniny rośnie, to zawsze rośnie poziom homocysteiny, zatem następuje połączenie dwóch “problemów”, przy czym sama metionina nie jest problemem, ale wysoka homocysteina już taki problem dla układu nerowego stanowi.
Plasma methionine rises, tHcy tends to rise also, so that patients with evidence of CNS abnormalities tend to have higher levels of tHcy. However at the higher methionine concentrations there is no apparent difference in the tHcy values between those with and without CNS abnormalities, indicating the response to methionine elevation is about the same in the two groups.
4.Jeżeli pojawia się wysoka metionina, dochodzą do tego problemy neurologiczne, to konsekwencją tego stanu, rzeczy jest po prostu zbyt mały poziom AdoMet, czyli S-adenosylometioniny. Zatem w takich przypadkach suplementacja SAm może być konieczna.
If the brain AdoMet levels in the MAT I/III-deficient patients follow the tendency reported by Young and Shalchi to decrease in the presence of especially high methionine, and fall below normal with the highest plasma methionines (a proposition that needs to be tested, at least on experimental animals) it would then be plausible to suggest that the CNS problems of MAT I/III deficiency with the higher elevations of methionine are due in part to lack of AdoMet. Such a suggestion, if correct, would provide not only an explanation of the CNS pathology, but also indicate why supplementation with AdoMet might be helpful.
WNIOSKI:
U 3 osób, które mają ten polimorfizm, nikt w życiu nie zastanawiał się nad wysoką homocysteiną…choć część członków rodziny umierało na choroby kardiologiczne, udary dużo wcześniej niż powinni.
Pomimo wiedzy na ten temat już 20 letniej, stale popełnia sie ten sam błąd przypisując winę za problemy innym genom, ale nie MAT.
Gdy analizujemy mechanizm wsparcia dla MAT, to nie ma on czegoś tak spektakularnego jak dla polimorfizmu MTHFR jest kwas foliowy. Tutaj mówimy o metylacji jako całości, cyklu Krebsa jako całości i magnezie potrzebnym by to połączyć. To powoduje, że leczenie tego polimorfizmu jest trudne i skomplikowane, gdyż musi uwzględnić to co jest przed nim…czyli mam gen Bogów jednak. ![]()